協同乳業株式会社のプレスリリース
消化管下部まで届いた食事由来の物質は、腸管内でマイクロバイオーム*1による代謝を受け、その代謝産物が宿主の健康に大きな影響を与えています。腸内マイクロバイオームは、ヒトの遺伝子数の100倍以上の遺伝子を保有し、この代謝にも関与していることから1つの臓器として捉える考え方が広まっています。しかしながら、多種多様の腸内細菌が棲息し、各々が独自の代謝経路を保有し絡み合っているため、集合体としては極めて複雑で、マイクロバイオームによる代謝経路や物質変換の研究報告は殆どありません。本研究グループは、アルギニンの経口投与で腸管内の生理活性物質ポリアミン濃度が上昇する現象を解明する目的で、腸内マイクロバイオームによる代謝経路を、ラットの腸管内で、安定同位体*2でラベル化したアルギニンとCE-TOFMS *3を用いて追跡調査を行いました。その結果、アルギニンからポリアミン(プトレッシン、スペルミジン)への変換が証明されるとともに、オルニチンやシトルリンなどの代謝経路の中間物質の菌体外への放出、さらにそれらは再吸収・利用され、ポリアミンまで変換され放出されるという集合的な生合成経路の存在が認められました。これは、腸内ポリアミン濃度をコントロールするための重要な知見であることを示すと共に、安定同位体ラベル追跡解析が他の食事成分や代謝産物に対しても応用できる可能性を示しています。さらに、マイクロバイオームの代謝系が多数の菌種による個々の代謝系の集合体であることを証明し、メタゲノム解析*4のような単独細菌のゲノム情報をベースとしたアプローチのみでは、発見困難且つ説明困難な集合的代謝経路が存在することを示しています。
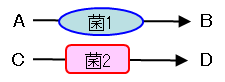
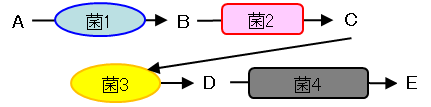
背景となる考え方
従来:前駆体(A、 C)が特定の菌に利用され代謝産物(B、 D)が生成
実際:前駆体(A)が様々な菌の中間体(B、 C、 D)を経て、代謝産物(E)が生成
ラット生体内での検証 検出された代謝産物と明らかになった代謝経路
【研究内容】
①糞便培養法による検証
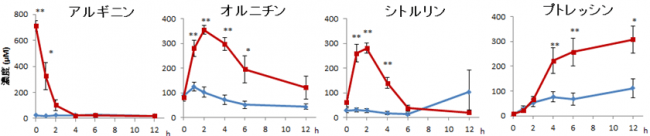
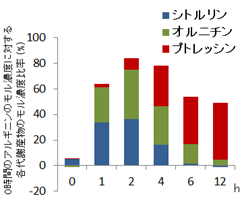
はじめに、集合体としての腸内マイクロバイオームによるアルギニンからプトレッシンへの代謝の経時的な変化をとらえるために、経路の中間体の産生について糞便培養法を用いて検証しました。その結果アルギニンは急速に消費されてオルニチンとシトルリンが増加し、それに遅れてプトレッシンが増加しました。これは菌体外へのオルニチンやシトルリンの放出が先に起こり、その後オルニチンやシトルリンからプトレシンが産生されていることを示唆しています(図1a)。また、添加したアルギニンのほとんどがオルニチン、シトルリンおよびプトレッシンに変化していることが確認されました(図1b)。
a
b
図1 アルギニン添加糞便培養におけるプトレッシンと代謝中間体の経時変化
a:アルギニンを1mMになるように添加(赤線)および生理食塩水を添加した(青線)糞便培養上清の代謝産物の経時的な変化。
b:アルギニン添加区における、0時間のアルギニンのモル濃度に対する各代謝産物のモル濃度比率。エラーバーは標準誤差(n = 7)を示す。
*p < 0.05、 **p < 0.01 (Two-way ANOVA with Bonferroni multiple comparison test )。
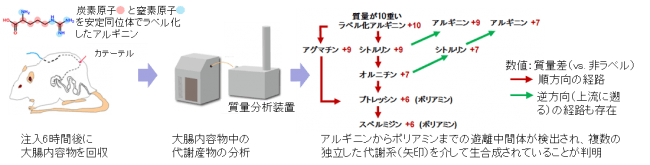
②ラット生体(腸管)内での検証
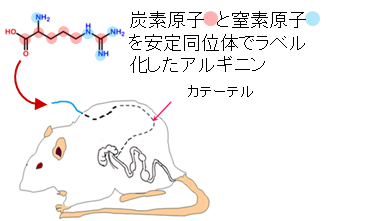
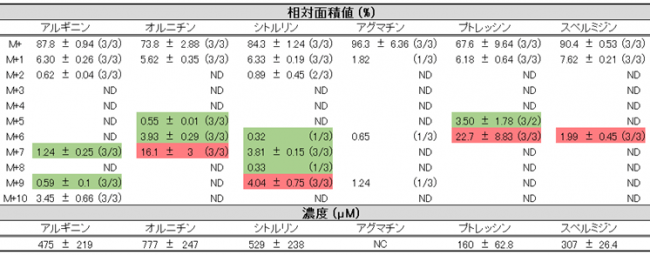
生体内でも中間体とプトレッシンの産生・放出が行われているのかを検証するため、カテーテルを介して大腸へ安定同位体でラベル化したアルギニンを注入し、腸内マイクロバイオームによる代謝産物の追跡を行いました(図2)。その結果、大腸内容物中にラベル化したアルギニンから順方向に産生されたと考えられる質量のポリアミン(プトレッシン、スペルミジン)および、中間体であるオルニチン、シトルリン、アグマチンが検出されました(表1赤欄)。また、興味深いことに、アルギニンからプトレッシンに至る順方向の代謝経路では産生されない質量数の中間体とプトレッシンも検出されました(表1緑欄)。これは、逆方向への代謝とそれにより産生された代謝産物の順方向への再利用が行われているためであると考えられます。
図2:大腸カニューレラットを用いた大腸への安定同位体ラベル化アルギニンの注入
注入6時間後の大腸内容物をCE-TOFMSで解析
表1 ラット大腸内容物中に検出された、同位体ラベル化代謝産物(抜粋)
平均±標準誤差(n = 3)。カッコ内の値は、その質量の化合物が検出された糞便試料の数/試験した糞便試料の数を表す。 ND: not detected。 NC : not calculated。
③糞便培養による中間体からのプトレッシン産生の検証
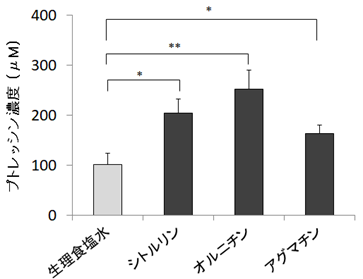
菌体外に放出された中間体が、再度吸収されプトレッシン合成に利用されているのかを確認するために、ラットの大腸内においてラベル化したアルギニン由来の質量数が検出された中間体であるシトルリン、オルニチン、アグマチンを添加した糞便培養実験を行いました。その結果、シトルリン、オルニチン、アグマチンを添加した培養上清では、生理食塩水のみを添加した培養上清(対照)と比較しプトレッシン濃度が有意に高いことが確認されました(図3)。このことから、一旦菌体外に放出されたこれらの中間体は、プトレッシン合成に利用されていると考えられ、中間体の菌体外への放出と利用を介した集合的な生合成経路の存在が示されました。
図3 菌体外中間体からのプトレッシンの産生
ラットの糞便にシトルリン、オルニチン、アグマチンを各々1mMとなるように添加し6時間の嫌気培養後、上清中のプトレッシン濃度を測定。エラーバーは標準誤差(n = 7)を示す。*p < 0.05、 *p < 0.01 (Student’s t-test vs 生理食塩水)。
④ラット腸内マイクロバイオーム中に存在するポリアミン合成を触媒する酵素の存在の検証
アルギニンからポリアミンを合成する酵素を含む細菌が、ラットの大腸内マイクロバイオームに存在するかどうかを調べました。16S rRNA遺伝子*5分類学的情報を利用して微生物群集の機能的属性を予測するPiphillinを用いた予測的機能遺伝子プロファイリングの結果、中間体の産生、プトレッシン、スペルミジンの産生を触媒する酵素遺伝子を持つと予測される菌がラット大腸内マイクロバイオーム中に存在することが確認されました(本リリースではデータ未掲載。論文中Table 2に掲載)。
実験①-④の結果を総合すると、遊離中間体の産生と放出、さらには逆方向への代謝も含んだ集合的な代謝経路が推測されます(図4)。
【まとめ】
アルギニンからポリアミン(プトレッシン、スペルミジン)への腸内マイクロバイオームによる変換が証明されるとともに、オルニチンやシトルリンなどの代謝経路の中間体の菌体外への放出、さらにそれらは再吸収・利用され、ポリアミンにまで変換・放出されるという集合的な生合成経路の存在が認められました。これは、腸内ポリアミン濃度をコントロールするための重要な知見であることを示すと共に、安定同位体ラベル追跡解析が他の食事成分や代謝産物に対しても応用できる可能性を示しています。さらに、マイクロバイオームの代謝系が多数の菌種による個々の代謝系の集合体であることを証明し、メタゲノム解析のような単独細菌のゲノム情報をベースとしたアプローチのみでは、発見困難且つ説明困難な集合的代謝経路が存在することを示しています。
【論文】
ジャーナル : Gut Microbes
論文タイトル: Intestinal luminal putrescine is produced by collective biosynthetic pathways of the commensal microbiome
著者 : Atsuo Nakamura(1)、 Takushi Ooga(2) & Mitsuharu Matsumoto(1)
(1)協同乳業㈱・研究所技術開発グループ、 (2)ヒューマン・メタボローム・テクノロジーズ株式会社